Traitement de la péri-implantite à l’aide du Laser
Publié par Dr François Bourdeau le
Par Dr François Bourdeau
Voici la traduction d’un article anglophone paru dans une édition spéciale du Oral Health Journal de septembre 2018.

François Bourdeau DMD, Diplomate ICOI, Directeur – Implantologie IDI
Source: https://www.oralhealthgroup.com/features/peri-implantitis-solea-co2-laser-clinical-case-report/
En cas d’ambiguïté, veuillez-vous référer à l’article original.
Introduction

Selon Seventh European Workshop on Implantology, 15 à 30% de tous les implants posés développeront une péri-implantite. Trois millions de personnes ont des implants et ce nombre augmente de 500 000 par année. Ainsi, le nombre de cas de péri-implantite atteindra 450 000 et 75 000 autres devraient s’ajouter chaque année. 1 Les cliniciens devront trouver les modalités de traitement appropriées pour résoudre ce problème qui est en croissance exponentielle.
Les modalités de traitement ont traditionnellement consisté en un traitement chimique, acide phosphorique, acide citrique et tétracycline. Ces moyens ont au mieux produit des résultats incohérents. En 2006, le Dr Robert Miller a publié un article dans «Implant Dentistry» sur l'utilisation de Er, Cr: YSGG pour désinfecter la surface de l'implant à l'aide d'un laser. L'utilisation de la thérapie au laser s'est avérée avoir un effet plus important que les moyens chimiques. Selon la publication de Miller, une profondeur de désinfection supérieure à 1 000 microns est possible, contre environ 100 microns 2lorsque des produits chimiques sont utilisés.
Le traitement au laser dentaire n'a pas produit de résultats cohérents en soi. Le 8 avril 2017, la réunion annuelle de l'Academy of Laser Dentistry a invité les entreprises à participer à l'élaboration d'un consensus sur un traitement du traitement de la péri-implantite pouvant fonctionner de manière cohérente. Les entreprises invitées étaient: Convergent, Biolase, Lightscalpel, Fotona et Millenium. Les entreprises qui ont choisi de participer étaient: Convergent, Biolase, Lightscalpel et Fotona. Différents critères ont été discutés et le groupe a formulé des recommandations de traitement sur l'utilisation de lasers comme complément lors du traitement d'une péri-implantite.
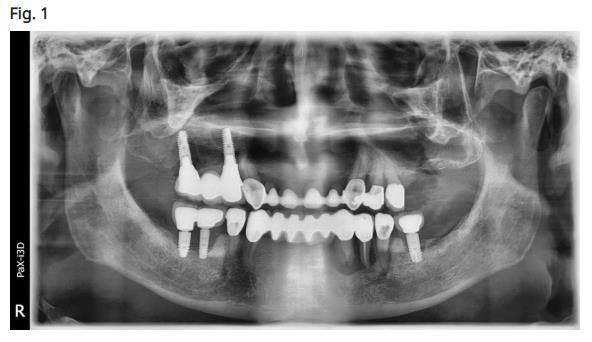
Edward R Kusek a présenté un laser utilisant un laser à 9300 nm CO2 (Convergent dental, Boston, Massachusetts). Dr. Kusek est un diplomate de ABOI, FAAID MALD MAGD. Le Dr Kusek a présenté l’utilisation de l’ADN oral en tant que pré-déterminant afin de dépister la prédisposition à la péri-implantite/maladie des gencives. Kusek a démontré deux cas distincts dans lesquels des patients avaient une maladie parodontale avancée (Fig. 1), mais leur ADN oral n’a pas indiqué une prédisposition à la maladie parodontale. Kusek a signalé une corrélation entre les patients présentant des génotypes à haut risque et une prédisposition plus élevée à un type de maladie péri-implantaire.
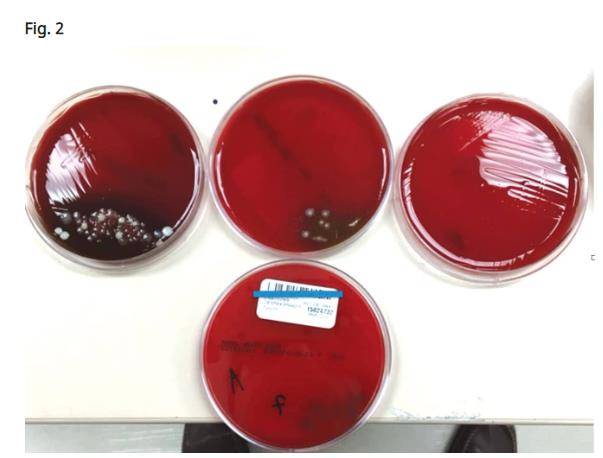
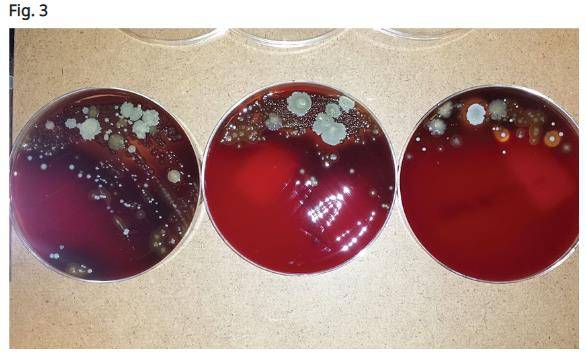
Kusek a rendu compte d'une étude détaillée qu'il avait menée dans son bureau en utilisant des prélèvements à l’aide d’écouvillons d’anaérobies autour des implants infectés. L'étude consistait en trois frottis. Le premier prélèvement a été effectué lorsque le tissu mou était réfléchi autour du tissu de granulation. Le deuxième prélèvement a été effectué après le retrait de tout le tissu de granulation autour des implants défaillants après qu’une brosse en titane eut été utilisée pour nettoyer toute la surface des filets exposés des implants. L’écouvillonnage final a été achevé après l’irradiation par le laser CO2 à 9300 nm. Les écouvillons ont ensuite été envoyés dans un laboratoire local. Ce laboratoire a été chargé de détecter les agents pathogènes parodontaux (Porphyromonas gingivalis, Prevotella intermedia, streptocoques bêta-hémolytiques, Campylobacter-Wolinella et autres espèces), afin de déterminer si présents autour d’un implant défaillant. La majorité des cas présentaient des taux élevés de bactéries sur le premier écouvillon, des quantités modérées sur le deuxième écouvillon et tous, sauf un, ne présentaient aucune prolifération bactérienne sur les surfaces irradiées par le laser CO2 à 9300 nm (Fig. 2). Celui des quatre cas plaqués présentant de fortes quantités de croissance bactérienne était un gros fumeur (Fig. 3).
Kusek a présenté huit cas de patients traités avec le laser à CO2 réglé à différents niveaux d'énergie. Deux cas ont démontré que le traitement utilisant des valeurs d'énergie plus faibles entraînait des échecs de traitement et une récurrence de l'infection. Lorsque des niveaux d'énergie supérieurs autour de 14 W ont été utilisés pendant au moins 40 secondes (plus de 550 J d'énergie), tous les cas ont été couronnés de succès. Par la suite, les deux cas ayant échoué ont été retraités avec des valeurs d’énergie plus élevées et sont maintenant couronnés de succès, un cas ayant une période postopératoire de plus d’un an.
Protocole de traitement de la péri-implantite assistée par laser
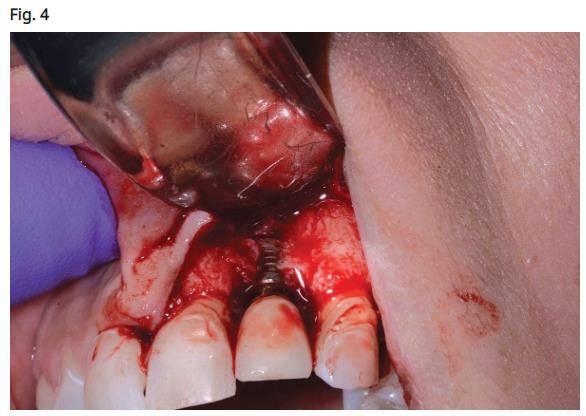
- L’extension du lambeau est réalisée à deux dents au-delà du site infecté à l’aide d’un laser CO2 à 9300 nm avec une seule incision de libération dans une position non esthétique (Fig. 4).
- Élévation du lambeau pour exposer tout tissu de granulation sur le corps de l’implant.
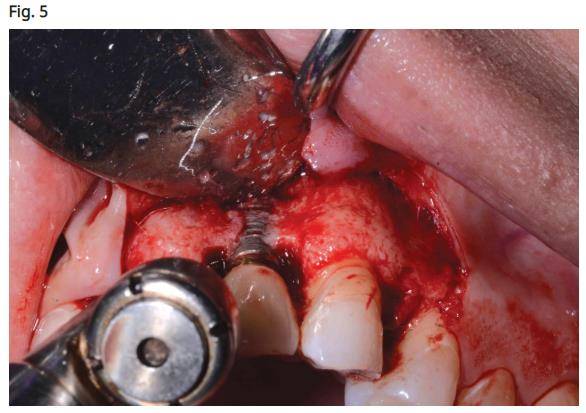
- Une pièce à main chirurgicale est utilisée pour retirer le tissu de granulation autour des filets du corps de l'implant (Fig. 5). Le traitement des défauts à trois ou quatre parois a un bon pronostic lorsqu'au moins la moitié du corps de l'implant est fixée dans l'os alvéolaire solide.
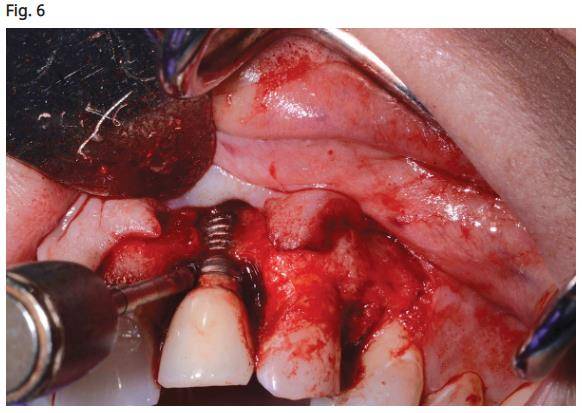
- Utilisation d’une brosse en titane (Salvin Dental Specialties, Charlotte, Caroline du Nord) pour nettoyer la surface de l’implant jusqu’à ce qu’il n’y ait plus de présence tissulaire sur la surface de l’implant visible avec des loupes (Fig. 6).
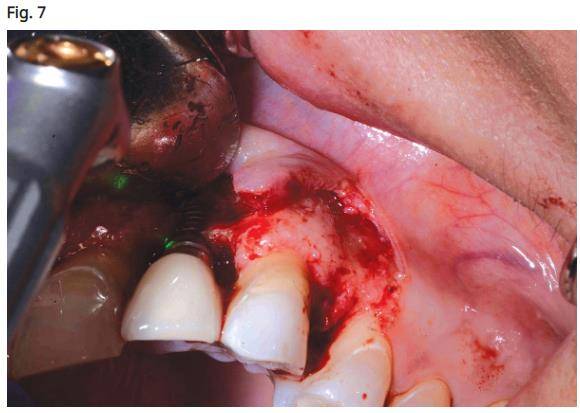
- L’utilisation du laser CO2 à 9300nm (Convergent dental Boston, Massachusetts) est réglée à 60%, ce qui donne une moyenne de 14 W d’énergie à la surface du corps de l’implant. La pointe du laser est positionnée à environ 15 mm de la surface de l’implant avec 1 mm taille de surface et un brouillard d’eau à 100% (fig. 7). L'utilisation d'un système de refroidissement à l'eau est nécessaire pour empêcher l'implant et la paroi osseuse de surchauffer, ce qui provoquerait la nécrose de l'os environnant.
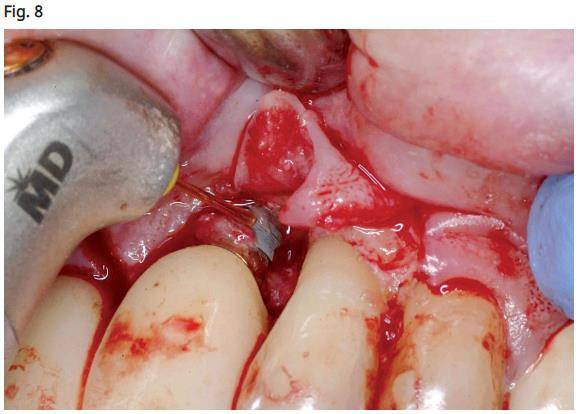
- Utilisation du laser Er, Cr: YSGG (Biolase, Irving, CA) autour des parois osseuses avec un réglage de 4,5W 31A / 21W avec une pointe MZ8 (800 microns) pour créer des points de saignement autour des parois osseuses (Fig. 8). Cela stimule les fibroblastes et facilite le processus de guérison (phénomène de micro-RAP).
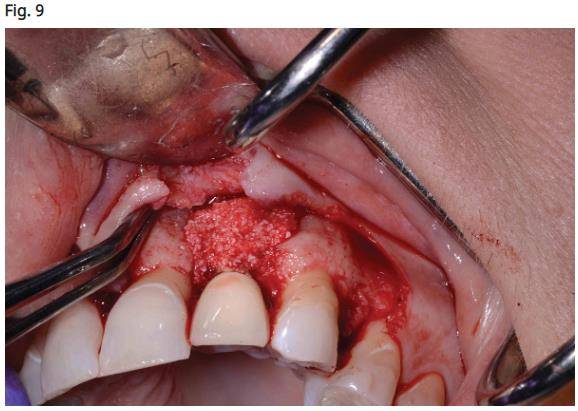
- Mise en place du matériau de greffe osseuse Bio Oss (Geistlich Pharm AG, Wolhusen, Suisse) imbibé de plasma de PRF (fibrine riche en plaquettes) et découpé en petits morceaux à placer autour du corps de l'implant (Fig. 9), suivi d'une couverture avec une membrane de collagène placée pour couvrir la partie interproximale de l’implant.
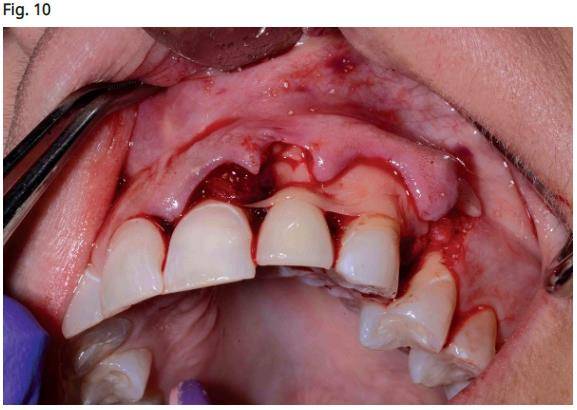
- Mise en place d'une membrane PRF (Intra-spin, Intra-Lock, Boca Rotan, Floride) pour recouvrir la membrane de collagène et le corps de l'implant (Fig. 10).
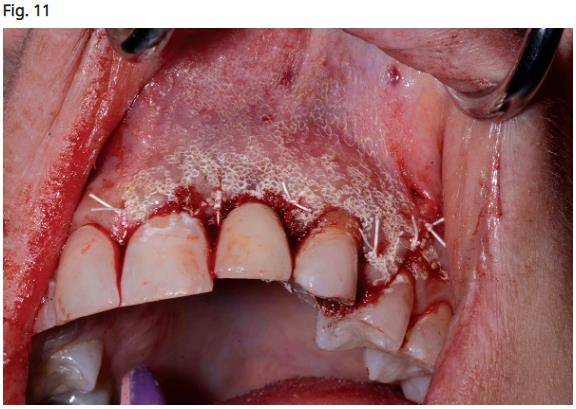
- La zone est suturée à l'aide de sutures 3.0 PTFE (Salvin Dental Specialties, Charlotte, Caroline du Nord) avec un matelassé horizontal profond pour les lambeaux repositionnés coronairement, suivies de sutures interrompues pour atteindre une fermeture primaire étanche.
- Utilisation du laser Er, Cr: YSGG 4.0W, 20Hz, 31A / 0W pour désépithélialiser les tissus jusqu’à 1 cm de tout le site chirurgical 5 afin de favoriser sa guérison (Fig. 11)
- Les sutures sont retirées environ deux semaines après l'opération.
- L'utilisation de la photo-bio-modulation (PBM) d'abord au moment de la chirurgie, à nouveau une semaine après la chirurgie et une dernière fois après deux semaines ou au rendez-vous du retrait de la suture.
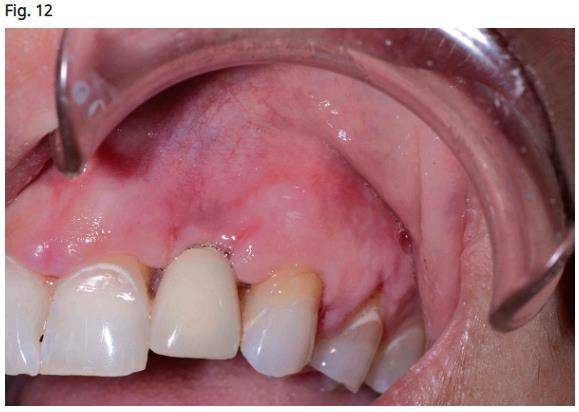
- Le patient doit garder la zone propre avec une brosse à dents manuelle et ne pas utiliser d'irrigants buccaux. Deux mois de guérison sont recommandés avant l'utilisation d'un irrigant oral ou de brosses à dents électriques (Sonic Care, Philips Care, Andover, MA / Oral B Cincinnati, OH). L’apparence des tissus six semaines après l’opération est visible à la figure 12.
- Les radiographies peuvent être prises à un rendez-vous de rappel après six mois. En utilisant ce protocole, Kusek a annoncé un taux de réussite de 100% pour le traitement de trois et quatre défauts de paroi.
Résumé
- L’utilisation d’un lambeau est nécessaire pour pouvoir accéder lors du traitement d'un défaut à trois ou quatre parois. Ce sont les seuls défauts qui se sont révélés être traitables.
- Le biofilm doit être éliminé à l'aide d'un polisseur à air à la glycérine (Air Flow ou HuFriedy) ou d'une brosse en titane (Salvin).
- L'utilisation de lasers Erbium ou CO2 est recommandée. Ils se sont révélés être les meilleurs lasers pour détoxifier la surface de l’implant sans créer de chaleur excessive qui risquerait de décoller le contact implant/os. Les lasers les moins efficaces pour ce traitement sont les diodes et Nd:YAG, car ils créent un excès de chaleur à la surface de l’implant métallique.
- La décortication de l'os entourant l'implant (Erbium) ou piézo-électrique et la désépithélisation des tissus mous extérieurs au lambeau (CO2 ou Erbium) doivent être effectuées.
- L'utilisation de produits biologiques (PRF) en combinaison avec une greffe de particules (généralement une xénogreffe) ou un matériau de greffe à résorption lente est recommandée.
- Avant de fermer le site, une membrane de collagène pour prévenir l’invagination des tissus, puis une membrane de PRF recouvrant la membrane de collagène, doivent toutes deux être appliquées.