Devrions-nous traiter les parodontites comme une infection? …ou comme une maladie inflammatoire?
Publié par D. Massé, HD1, J. Jones, RDH2, J. Simard, RDH3, L. Golub, DMD, MSc, MD4, Y. Gu, D.D.S., PhD5, M E Ryan, D.D.S., Ph.D.6 le
Par D. Massé, HD1, J. Jones, RDH2, J. Simard, RDH3, L. Golub, DMD, MSc, MD4, Y. Gu, D.D.S., PhD5, M E Ryan, D.D.S., Ph.D.6
Une des pierres angulaires de notre profession est l’application d’un esprit critique. Celui-ci a été défini comme étant : « la capacité à s’interroger avec exigence et rationalité sur la réalité ou la probabilité des faits et des relations ou autrement dit la capacité de défier sa propre réflexion. »1
Considérons donc la question suivante : devons-nous traiter les maladies parodontales comme des infections ou comme des maladies inflammatoires ? Si les parodontites étaient simplement des maladies infectieuses, on supposerait alors que par l’utilisation de mesures thérapeutiques judicieuses visant la réduction du fardeau microbien, de grandes avancées auraient pu être faites dans l’éradication de la maladie. Une maladie infectieuse est définie par l’Organisation mondiale de la santé (OMS) comme étant « une maladie causée par les micro-organismes pathogènes, comme les bactéries, les virus, les parasites ou les champignons, pouvant être transmise, directement ou indirectement, d’une personne à une autre. »2 Or, en tant que professionnels de la santé buccale, nous savons que ce n’est simplement pas le cas. Il est maintenant établi que les maladies parodontales sont parmi les maladies chroniques non transmissibles les plus prévalentes, au même titre que les maladies cardiovasculaires et le diabète.
Environ un Américain sur deux âgé de plus de 30 ans présente une forme ou l’autre de maladie parodontale selon le rapport du Centers for Disease Control and Prevention publié en août 2012.3 Il est estimé que 47,2 pour cent, soient 64,7 millions d’Américains souffrent de maladies parodontales selon les résultats du National Health and Nutrition Survey. La prévalence augmenterait aussi haut que 70,1 pour cent chez les adultes de 65 ans et plus.4
La question se pose : atteignons-nous les résultats escomptés en traitant les maladies parodontales comme une infection ? Le détartrage sous-gingival, le surfaçage radiculaire, l’emploi des antimicrobiens et l’utilisation des antibiotiques systémiques à court terme n’ont tout simplement pas donné les résultats thérapeutiques espérés. Une métaanalyse visant à étudier l’efficacité des antibiotiques systémiques a été menée par Cunha-Cruz et coll. en 2008. Les résultats nous permettent de conclure à un manque d’association entre l’utilisation des antibiotiques systémiques et la diminution de la perte de dents. Ceci, couplé avec les préoccupations croissantes au sujet de la résistance aux antibiotiques, renforce l’inquiétude que la prescription d’antibiotiques pour le traitement des maladies parodontales destructives chroniques ne doit être effectuée qu’avec une extrême précaution.5 (Remarque : inversement, dans la même étude l’utilisation de la doxycycline en dose sous-antimicrobienne (Periostat) a entraîné une diminution de la perte des dents).
C’est à la fin des années 1980 que plusieurs études significatives ont commencé à vouloir tirer la conclusion que la maladie parodontale était en fait une maladie inflammatoire.6 L’idée fut soulevée de considérer l’aspect de la réponse destructrice de l’hôte lui-même comme un facteur étiologique causal des maladies parodontales. Ces études, et des centaines de documents connexes, ont mené à la réalisation que ce serait la réponse inflammatoire de l’individu, suivie par la réponse immunitaire qui expliquerait la pathogenèse de la destruction des tissus parodontaux.7
De nouvelles données suggèrent maintenant que les agents pathogènes parodontaux présents, initialement en plus ou moins grand nombre, utilisent l’inflammation pour fournir un environnement favorable à leur croissance. L’implication étant que le biofilm pathologique « émergerait » à la suite de l’inflammation.7 Les méthodes traditionnelles d’identifier la maladie active se sont principalement appuyées sur la mesure de la profondeur des poches. Or, celles-ci sont souvent des indicateurs de la maladie passée plutôt qu’active. Par conséquent, l’accent devrait être mis sur les biomarqueurs inflammatoires en plus des mesures de pertes d’attaches.
La transition d’une maladie infectieuse à une maladie inflammatoire a ainsi été redéfinie par l’Académie américaine de parodontologie (AAP) en 2008. Aujourd’hui, l’AAP réfère à la parodontite comme étant une maladie inflammatoire avec des effets destructeurs potentiels multiples sur la santé systémique. « Pendant longtemps, on a pensé que les bactéries étaient le facteur reliant les maladies parodontales à d’autres maladies systémiques. Les recherches plus récentes démontrent toutefois que ce serait l’inflammation qui serait responsable de ces associations. Par conséquent, le traitement de l’inflammation (et de ses résultantes, dont la surproduction d’enzymes destructives comme la collagénase et les métalloprotéinases MMP) peut non seulement aider à gérer les maladies parodontales, mais aussi être bénéfique à l’amélioration de plusieurs autres conditions inflammatoires chroniques »8
Les médiateurs de l’inflammation comme cause de la destruction tissulaire
Un article publié dans le magazine TIME et repris par l’Inflammation Research Foundation qui titrait « The Secret Killer »,9 décrit la réponse inflammatoire comme étant en quelque sorte une bouée de sauvetage permettant de prime abord à notre corps de repousser les invasions bactériennes, virales et parasitaires. Au moment même où ces intrus entrent en action, un système immunitaire qui fonctionne bien réagit pour engloutir les envahisseurs étrangers et ainsi aider au contrôle de la réponse inflammatoire. Dans des conditions normales, le processus suit son cours donnant la chance au corps de se défendre et de guérir. Lorsqu’en présence d’une variété d’autres maladies inflammatoires associées à la parodontite (par exemple la maladie de Crohn, la polyarthrite rhumatoïde, les maladies cardiovasculaires), ce procédé n’est pas résolu et le prolongement de l’inflammation entraîne la destruction des tissus de l’hôte.
L’un des sujets les plus étudiés par la recherche médicale d’aujourd’hui est la destruction causée par la réponse inflammatoire lorsqu’une infection transitoire devient chronique. Le même processus bénéfique lors d’une infection passagère peut littéralement tourner le corps contre lui-même lorsque l’inflammation persiste. La population d’aujourd’hui, soumise aux habitudes d’un mode de vie occidental comme une alimentation riche en sucre et en graisse saturée, accompagnée de peu ou pas d’exercice, facilite la persistance de l’inflammation chronique.9
Le rôle de l’inflammation chronique et de son association avec des maladies aujourd’hui les plus répandues comme les maladies cardiovasculaires, la maladie d’Alzheimer, les cancers, le diabète et les troubles auto-immuns sont bien documentés.10 Les maladies cardiovasculaires (MC) demeurent la première cause de décès dans le monde. Bien que des facteurs de risques traditionnels soient identifiés comme jouant un rôle potentiel dans le développement des MC, l’inflammation chronique est aussi aujourd’hui postulée comme jouant un rôle dans le développement et la propagation de ces maladies. Une revue systématique sur le sujet a été réalisée par Roifman et coll. et publiée dans le Canadian Journal of Cardiology. L’objectif de cette revue systématique était de déterminer si les patients atteints de maladies inflammatoires chroniques étaient plus à risque de développer des maladies cardiovasculaires (MC). Les résultats indiquent que les patients atteints de maladies inflammatoires chroniques sont effectivement à risque plus élevé pour le développement de MC.11 L’inflammation chronique est maintenant identifiée comme jouant un rôle potentiellement important dans le développement de l’athérosclérose, une cause principale des MC.12 À cet égard, les parodontites, maladies inflammatoires chroniques très répandues, sont de plus en plus reconnues comme ayant une association et même une relation de causalité potentielle avec les maladies cardiovasculaires.13, 14
Un ensemble considérable d’éléments et d’études étaient aussi la conclusion que l’inflammation chronique peut prédisposer un individu à certains types de cancer comme le démontre l’association entre les maladies chroniques inflammatoires de l’intestin et l’augmentation du risque de cancer du côlon. Plus longtemps l’inflammation persiste, plus le risque de carcinogénèse augmente.15 Les états inflammatoires chroniques associés à l’infection et l’irritation peuvent conduire à des environnements qui favorisent les lésions génomiques et l’initiation de tumeurs.16
Traitement des maladies parodontales comme une maladie inflammatoire
Tenons-nous suffisamment compte de l’envergure des effets de l’inflammation parodontale sur l’ensemble du corps ? Et si oui, traitons-nous vraiment la maladie parodontale telle qu’elle est maintenant définie par les principales autorités, à savoir comme une maladie inflammatoire ?
La caractéristique fondamentale commune des maladies inflammatoires est la libération à la hausse des médiateurs de l’inflammation tels les cytokines, les prostaglandines et les métalloprotéinases ou MMP. La seule différence entre la réponse inflammatoire des maladies telles que la polyarthrite rhumatoïde, l’athérosclérose, la maladie de Crohn et la maladie parodontale est leur localisation anatomique.
La libération excessive de collagénase (MMP-8), ainsi que d’autres MMP moins importants (MMP-13, MMP-12), est reconnue comme un événement clé dans la pathogenèse de la maladie parodontale. Le collagène constitue 60 % des tissus gingivaux et du ligament parodontal et 90 % de la matrice organique (partie vivante) de l’os. Les cristaux de phosphate de calcium sont intégrés au sein de cette matrice de collagène et constituent la partie minérale (dure) de l’os. La destruction du collagène dans les tissus parodontaux est largement causée par les niveaux élevés de MMP qui attaquent la matrice organique vivante.
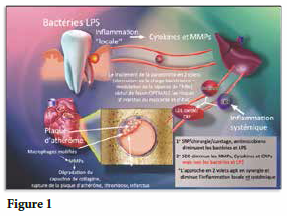
Un événement majeur dans le lien entre la parodontite locale et les conditions systémiques et médicales qui y sont maintenant reliées est la libération par les tissus parodontaux inflammés de ces médiateurs inflammatoires qui empruntent ensuite la circulation sanguine et se déplacent vers le foie. La cascade d’événements suivante (fig.1) illustre comment l’inflammation chronique joue un rôle étiologique important dans l’exacerbation d’un accident vasculaire cérébral ou un infarctus du myocarde. Une fois que les médiateurs inflammatoires (par exemple, dérivés de la gencive inflammée) sont présents dans le sang, le foie est alors sollicité pour produire des protéines qui sont à la fois des médiateurs et des marqueurs diagnostiques des maladies inflammatoires ; les plus courantes étant les C-réactives protéines (CRP).
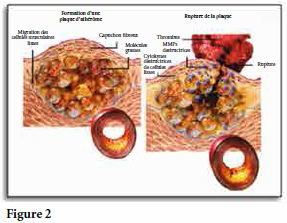
Pour ajouter l’insulte à l’injure, le cholestérol de basse densité (LDL), lorsqu’oxydé par la réponse inflammatoire, forme une réaction chimique avec ces CRP. Le résultat en fait un complexe de LDL oxydé/CRP qui est ensuite reconnu et pris en charge par les macrophages dans les plaques d’athéromes. Ces macrophages, en essayant d’éradiquer les molécules grasses, se différencient en cellules spumeuses qui sont caractéristiques des plaques de lipides chargées dans les artères. Ils sont une indication de l’accumulation de plaque dans l’athérosclérose, qui est couramment associée à un risque accru de crise cardiaque et d’AVC.
Pire, ces cellules spumeuses (des macrophages modifiés) vont à leur tour libérer des MMP, notamment des MMP-8 (collagénase). Or, la fonction principale de la collagénase étant de détruire le collagène, le capuchon protecteur de collagène qui encapsule la plaque d’athérome est maintenant en danger. Lorsque détruit par la collagénase, il en découle une suite d’événements tels la thrombose ou l’infarctus du myocarde (crise cardiaque). (Fig.2)
Un appel à la profession
La profession dentaire ne peut plus se permettre d’ignorer l’impact de la maladie inflammatoire chronique la plus commune de l’humanité : la parodontite ! Les conséquences de l’inflammation parodontale chronique rendent la guérison impossible et la complication des maladies systémiques plus probable. Dans un état normal, le corps humain détruit naturellement le vieux collagène qui est remplacé par un nouveau dans un processus d’équilibre. Dans la maladie inflammatoire chronique, la collagénase, particulièrement la MMP-8, est libérée continuellement en excès. Le processus de réparation se trouve en déséquilibre et il en résulte une destruction des tissus. Jusqu’à la résolution de la réponse inflammatoire, nous sommes à un point mort dans la progression de nos traitements et à risques de récidives ou de résultats imprévisibles.
Et s’il était maintenant possible de ralentir la dégradation du collagène en inhibant la surproduction de la collagénase pour l’amener à un niveau acceptable ? Dans leurs études menées à la Stony Brook University (New York) sur les mécanismes de destruction du collagène et de la maladie parodontale, Golub et ses collègues ont fait une découverte tout aussi inattendue que marquante; à savoir que les tétracyclines, une classe de médicaments reconnue jusqu’alors uniquement comme antibiotiques, avaient aussi le potentiel de bloquer la libération de la collagénase chez les mammifères.6 Cette découverte excitante conduit à de nouvelles recherches visant à développer une formulation de la doxycycline qui inhiberait la collagénase (MMP- 8) et d’autres MMP, mais sans avoir les effets indésirables de l’antibiotique. (Fig.3)
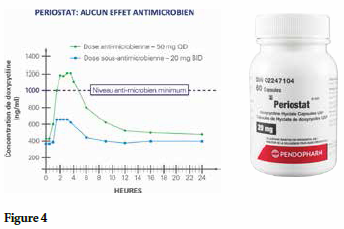
Il a été découvert qu’à une dose sous-antimicrobienne (20 mg), la doxycycline élimine les effets secondaires typiques de l’antibiotique pour n’en garder que ses effets sur la collagénase. (Fig.4) Cette médication est aujourd’hui connue et prescrite sous le nom de Periostat®. Plus de 10 millions d’ordonnances ont été rédigées à ce jour uniquement aux É.-U., ce qui en fait la médication la plus largement utilisée dans le monde pour le traitement de la maladie parodontale.
L’American Dental Association (ADA) et le Council on Scientific Affairs ont publié conjointement la déclaration suivante : « Periostat® s’est démontré efficace pour aider à stopper la progression de la parodontite, lorsqu’utilisé selon les directives, en complément du détartrage et du surfaçage radiculaire, dans un programme consciencieux d’hygiène buccale et de soins professionnels réguliers. » [Note : scientifiquement, Periostat® est décrit comme SDD ou ’Sub-antimicrobial Dose Doxycycline’.]
Plusieurs études cliniques conduites en double aveugle sur des patients atteints de parodontite et publiées dans des revues scientifiques comparant les résultats entre les traitements SRP (Scaling- Root Planning) + SDD et ceux SRP + placebo ont démontré les conclusions suivantes :
- SRP + SDD significativement plus efficace que SRP + placebo, sans les effets secondaires antibiotiques.17-20
- 75 % moins de dents perdues chez les patients SRP + SDD21
- Réduction de 80 % à 90 % des poches « actives » chez les patients SRP + SDD 21-28 ; les poches actives étant définies comme celles devenant plus profondes avec le temps. Pas d’effet « rebond ».17, 29
- Réduction de 50 % à 60 % des médiateurs biologiques de la dégradation tissulaire et osseuse (MMP-8/collagénase, MMP-9, IL-1ß).17, 30
- Chez les parodontites à progression rapide, l’ajout de SDD (versus placebo) a produit une réduction de 73 % des poches actives ; en plus d’un gain d’attache de 2 à 3 fois supérieur (2,2 mm contre 0,8 mm) ; et une réduction significative de l’indice de saignement (BOP).18, 24, 25
L’American Dental Association (ADA) publiait en juillet 2015 ses lignes directrices en regard d’un guide des protocoles de traitements non chirurgicaux des parodontites chroniques « ADA Guidelines with Respect to Nonsurgical Treatment of Chronic Periodontitis ».26 Suite à une revue systématique de 72 articles scientifiques, l’ADA ne se prononçait en faveur que de 2 protocoles de traitements non chirurgicaux dans les cas de parodontites chroniques modérées à sévères, soit le surfaçage des racines seul et le surfaçage en association avec Periostat (SDD).
Qui pourrait bénéficier d’un traitement SDD ?
Avec le vieillissement de la population, notre clientèle dentaire se présente de plus en plus avec d’autres maladies connexes telles le diabète, les maladies cardiovasculaires et plusieurs autres, toutes avec un dénominateur commun : la réponse inflammatoire. Le succès de la thérapie à la doxycycline à dose sous-antimicrobienne, d’abord approuvée par la FDA américaine et par Santé Canada pour la maladie parodontale, s’est avérée aussi avoir un impact retentissant sur d’autres maladies à caractère inflammatoire, ce qui évidemment a attiré une attention importante de la communauté médicale.
« La seule différence entre la réponse inflammatoire des maladies telles que la polyarthrite rhumatoïde, l’athérosclérose, la maladie de Crohn et la maladie parodontale est leur localisation anatomique. »
Les patients diabétiques
Plus d’un Canadien sur quatre vit avec le diabète ou le pré-diabète. On prévoit que ce chiffre passera à plus d’un sur trois en 2020.31 Il est bien connu que la parodontite chronique est plus répandue et plus sévère chez le patient diabétique. Une étude multicentrique de 6 mois, avec essais cliniques randomisés, a été menée sur des participants qui avaient le diabète de type 2. Tous prenaient des doses stables de médicaments, avaient un taux d’HbA1c entre 7 et 9 (ie., hyperglycémie mal contrôlée) et une parodontite chronique non traitée. 514 participants ont été évalués (n = 257) recevant SRP plus un rince-bouche à la chlorhexidine plus des traitements de soutien à 3 et à 6 mois. Le groupe témoin (n = 257) n’a reçu aucun traitement pendant les 6 mois. À 6 mois, les concentrations moyennes de HbA1c dans le groupe de thérapie parodontale avaient augmenté de 0,17 % comparativement à 0,11 % dans le groupe de contrôle, sans autres différences significatives entre les groupes. L’étude a conclu que la thérapie parodontale non chirurgicale n’a pas amélioré le contrôle glycémique chez les patients atteints de diabète de type 2 et de parodontite chronique modérée à avancée. Ces résultats ne soutiennent pas l’utilisation d’un traitement parodontal non chirurgical chez les patients diabétiques dans le but d’abaisser les taux d’HbA1c.32
Comparativement, des résultats radicalement différents ont été remarqués dans un essai pilote clinique de 3 mois, randomisé et contrôlé par placebo qui comprenait 45 patients diabétiques de type 2 de longue date avec parodontite chronique non traitée. Les sujets ont reçu un traitement parodontal non chirurgical conventionnel combiné avec, soit (a) un traitement de 3 mois de doxycycline à dose sous-antimicrobienne (SDD), ou (b) un régime de deux semaines de thérapie antibiotique, ou (c) un placebo. Les sujets recevaient simultanément des doses stables de médicaments hypoglycémiques oraux et/ou de l’insuline. La réponse aux traitements a été évaluée par la mesure de l’hémoglobine A1c (HbA1c), du glucose plasmatique, et des mesures parodontales cliniques. À 1 et 3 mois de suivi, les mesures cliniques parodontales avaient diminué dans tous les groupes. À trois mois, les concentrations moyennes de HbA1c dans le groupe SDD ont été réduites de 7,2 ± 2,2 unités (± SD), à 6,3 ± 1,1 unités, ce qui représente une amélioration de 12,5 %. En revanche, il n’y avait pas d’amélioration significative de l’HbA1c dans le groupe avec antibiotiques (7,5 ± 2,0 à 7,8 ± 2,1) ou avec placebo (8,5 ± 2,0 à 8,5 ± 2,6). Les résultats de cette étude pilote suggèrent que le traitement de la parodontite avec détartrage sous-gingival et trois mois de doxycycline à dose sous-antimicrobienne peut diminuer le taux d’HbA1c chez les patients atteints de diabète de type 2 qui prennent des agents hypoglycémiques normalement prescrits.33
Les patients avec maladies cardiovasculaires
Les effets de la thérapie à la doxycycline à dose sous-antimicrobienne ont été largement étudiés pour son potentiel à réduire les CRP, biomarqueurs sériques de l’inflammation systémique. Les CRP ainsi que plusieurs autres biomarqueurs sériques sont largement étudiés parce qu’ils identifient un facteur de risque dossier de maladie coronarienne (MC). Il est reconnu que les patients démontrant un taux élevé de CRP dans leurs échantillons de sang présentent des risques plus élevés d’avoir de futurs troubles cardiaques. L’un des groupes identifiés comme particulièrement à risque de MC serait les femmes post-ménopausées.34, 35
Une étude randomisée à double insu avec essais cliniques contrôlés par placebo, menée par Payne et coll. et publiée dans le JADA de mars 2011, assignait aléatoirement 128 femmes post-ménopausées souffrant de parodontite chronique à une posologie biquotidienne de doxycycline à dose sous-antimicrobienne ou à un placebo pour deux ans en complément à la thérapie de maintenance parodontale. Après le protocole de deux ans, la SDD avait réduit de manière significative les biomarqueurs inflammatoires sériques (CRP et MMP) en plus d’avoir augmenté le taux de bon cholestérol (HDL), celui-ci corrélé à un risque réduit de l’athérosclérose.36
Tel que discuté précédemment, l’inflammation chronique, en incitant les macrophages à sécréter en excès des MMP, a comme effet de dégrader le collagène du capuchon de protection des plaques d’athéromes, de les déstabiliser et/ou de les fractionner, causant la thrombose ou l’infarctus. L’hypothèse suivante a été émise : si l’activité des MMP pouvait être inhibée ou supprimée, il pourrait y avoir moins de risques de rupture de la coiffe de protection. Une étude pilote de 6 mois en double aveugle, randomisée et avec placebo, a été menée afin de comparer l’efficacité de la thérapie SDD versus un traitement avec placebo pour réduire l’inflammation et prévenir les événements de rupture. Un total de 50 patients, tous diagnostiqués avec des troubles coronariens sévères, ont été évalués : 24 du groupe ont reçu un placebo et 26 la SDD (30 patients ont complété l’étude de 6 mois ; 13 placebos et 17 SDD). Chez les patients traités avec SDD, le taux de C-réactive protéine a été réduit de 46 %, alors que non significativement réduit chez les patients sous placebo. Le taux d’interleukine (IL)-6 a aussi diminué chez les patients traités par SDD, mais non de façon significative chez les patients traités par placebo. Le taux de MMP-9 (également connu sous le nom collagénase de type IV) a également été réduit de 50 % dans le groupe SDD, alors qu’inchangé par le traitement avec placebo. L’étude conclut que la SDD semble exercer des effets potentiellement bénéfiques sur l’inflammation, ce qui pourrait promouvoir la stabilité des plaques d’athéromes et prévenir les accidents cardiovasculaires.37
« Le traitement de l’inflammation et de ses résultantes peut non seulement aider à gérer les maladies parodontales, mais aussi être bénéfique à l’amélioration de plusieurs autres conditions inflammatoires chroniques. »
Les patients avec ostéopénie/ostéoporose
L’ostéoporose, maladie caractérisée par une faible masse osseuse et une détérioration des os, entraîne leur fragilité, augmente les risques de fractures, d’invalidité et de décès dans certains cas (28 % des femmes et 37 % des hommes qui souffrent d’une fracture de la hanche meurent dans l’année suivante).38 Une étude préliminaire avec essais cliniques en double aveugle et placebo menée par Payne et coll.39 a démontré qu’un traitement par SDD chez des femmes ménopausées souffrant de parodontite et d’ostéopénie (réduction de la masse osseuse de sévérité moindre que l’ostéoporose) avait réduit la progression de la maladie parodontale y compris la diminution de perte d’os alvéolaire et des biomarqueurs de la destruction du collagène et de la résorption osseuse dans les poches parodontales.
Une étude antérieure menée par Golub et coll. (1999), en utilisant un modèle d’ostéoporose post-ménopausique sur le rat, a clairement démontré que l’administration orale d’une doxycycline à dose non antimicrobienne avait non seulement réduit la gravité de la perte osseuse systémique dans le tissu osseux (fémur), mais aussi la perte osseuse locale dans le parodonte et une réduction de la collagénase dans les tissus gingivaux voisins.40
Dans une étude commandée par le National Institutes of Health (NIH), sur 600 femmes évaluées, 128 ont été sélectionnées. Les participantes devaient être post-ménopausées, souffrir d’ostéopénie, démontrer des preuves radiographiques de perte d’os alvéolaire et ne pas être sous médication de type bisphosphonate ou autres qui auraient une incidence sur l’ostéoporose. Les 128 femmes post-ménopausées souffrant de parodontite chronique et d’ostéopénie reçurent de façon aléatoire la SDD ou un placebo pendant deux ans avec des traitements d’entretien parodontal tous les 3-4 mois. Des prélèvements sanguins ont été effectués au début, à 1 et 2 ans. Les sérums ont été analysés pour la résorption et la formation osseuse de même que pour les biomarqueurs. En conclusion, le protocole de 2 ans avec la thérapie SDD a non seulement réduit les marqueurs cliniques, radiologiques et biochimiques de la maladie parodontale chez les femmes post-ménopausées, mais aussi réduit le risque de conversion de légère perte osseuse systémique (ostéopénie) à une forme plus sévère de la maladie osseuse (ostéoporose).41
Les patients avec polyarthrite rhumatoïde
Historiquement, la parodontite et la polyarthrite rhumatoïde ont été reliées. Le manque de dextérité manuelle causée par l’arthrite rendant l’élimination de biofilm peu efficace était l’explication avancée depuis plusieurs décennies. Nous comprenons maintenant qu’il existe aussi un lien impliquant l’inflammation et le système vasculaire. Les médiateurs de l’inflammation (cytokines, prostaglandines, MMP) présents dans l’inflammation parodontale circulent aussi dans le sang de façon bi-directionnelle, entraînant une inflammation systémique. Le profilage élevé des marqueurs inflammatoires est similaire pour les deux, la parodontite et la polyarthrite rhumatoïde (PR).
Une étude clinique a été menée pour comparer l’efficacité de la doxycycline (SDD) en association avec du méthotrexate (MTX) versus le MTX seul dans le traitement de la polyarthrite rhumatoïde séropositive débutante, ainsi que pour tenter de différencier les effets antibactériens et anti-métalloprotéinase de la doxycycline. Soixante-six patients atteints de polyarthrite rhumatoïde depuis plus d’un an et qui n’avaient pas été préalablement traités avec des médicaments anti-rhumatismaux ont été randomisés pour recevoir : a) 100 mg doxycycline deux fois par jour avec le MTX (groupe avec forte dose antibiotique), b) 20 mg doxycycline deux fois par jour avec le MTX (faible dose sous-antibiotique), ou c) un placebo avec le MTX (groupe placebo). Il s’agissait d’une étude en double aveugle de deux ans.
L’étude a conclu que chez les patients séropositifs avec PR débutante, le traitement initial avec le MTX et la doxycycline était supérieur au traitement avec le MTX plus placebo. Les réponses thérapeutiques à faible dose et à dose élevée étaient essentiellement les mêmes, sauf que le groupe doxycycline à dose élevée présentait plus d’effets secondaires alors que le groupe SDD était similaire au groupe placebo, suggérant que les effets anti-collagénase SDD sur la réponse de l’hôte étaient responsables des effets bénéfiques sur la PR plutôt que l’effet antibactérien de la doxycycline à forte dose.42
Conclusion
La quantité de documentation scientifique appuyant les traitements avec la doxycycline à dose sous-antimicrobienne est concluante. Bien que tout ait commencé en ciblant les parodontites, les découvertes ont ouvert la voie à des possibilités inattendues de traitements pour plusieurs autres maladies telles la pemphygoïde, la rosacée, l’acné, l’arthrite rhumatoïde, la perte osseuse post-ménopausale, les maladies cardiovasculaires et certaines formes de cancer.
En tant que professionnels de la santé, il est temps de passer des paroles aux actes et de jouer notre plein rôle dans le maintien de la santé globale de nos patients. Il est temps de changer nos paradigmes concernant les maladies parodontales et de considérer le contrôle de la réponse de l’hôte à l’aide de la SDD comme une composante importante des traitements.
Pour implanter un département de parodontie interceptive efficace et responsable, contactez Isabelle Lavallée, Directrice des services de consultations.isabelle@idi.org514.795.1281 |
Déclaration des auteurs :
Les auteurs n’ont reçu et ne retirent aucune compensation relative à la rédaction de cet article.
- Denis Massé, HD Directeur de programmes Institut dentaire international
- Jo-Anne Jones, RDH Présidente, RDH Connection Inc. Conférencière internationale
- Jacinthe Simard, RDH Conférencière et consultante Institut dentaire international
- Lorne M. Golub, DMD, MSc, MD (Honoraire) Professeur SUNY Distinguished Département de biologie et pathologie buccales Stony Brook School of Dental Medicine, S.U.N.Y
- Ying Gu, D.D.S., Ph.D Professeur associé Département de dentisterie générale Stony Brook School of Dental Medicine
- Maria Emanuel Ryan, D.D.S., Ph.D Professeure et présidente Département de biologie et pathologie buccales Stony Brook School of Dental Medicine
Références :
- http://www.who.int/topics/infectious_diseases/en/
- CDC: Periodontal Disease http://www.cdc.gov/oralhealth/periodontal_disease/
- CDC survey finds ’high burden’ of disease among adults August 30, 2012 http://www.ada.org/en/publications/ada-news/2012-archive/august/prevalence-of-periodontitis
- Cunha-Cruz J, Hujoel PP, Maupome G, Saver B. Systemic Antibiotics and Tooth Loss in Periodontal Disease. J Dent Res. 2008 Sep;87(9):871-876.
- Golub LM, Lee HM, Ryan ME et al. Tetracyclines inhibit connective tissue breakdown by multiple non-antimicrobial Brookfield S. Developing Critical Thinkers: Challenging Adults to Explore Alternative Ways of Thinking and Acting. San Francisco: Jossey-Bass: 1987.
- Mechanisms. Adv Dent Res 1998;12:12-26.
- Van Dyke, TE. Periodontitis is characterized by an immuneinflammatory host-mediated destruction of bone and connective tissues that support the teeth. J Periodontol. April 2014.
- www.perio.org/consumer/other-diseases
- http://www.inflammationresearchfoundation.org/inflammation-science/inflammation-details/time-cellular-inflammation-article/
- Willerson JT, Ridker PM. Inflammation as a Cardiovascular Risk Factor. Circ Journ 2004; 109: II-2-II-10.
- Roifman I, Beck PL, Anderson TJ et al. Chronic inflammatory diseases and cardiovascular risk: a systematic review. Can J Cardiol. 2011 Mar-Apr;27(2):174-82. dossier
- Wilson, PW. Evidence of systemic inflammation and estimation of coronary artery disease risk: a population perspective. Am J Med. 2008 Oct;121(10 Suppl 1):S15-20.
- Craig RG, Yip JK, So MK, et al. Relationship of destructive periodontal disease to the acute-phase response. J Periodontol. 2003;74(7):1007–1016.
- Friedewald VE, Kornman KS, Beck JD, et al. The American Journal of Cardiology and Journal of Periodontology Editors’ Consensus: periodontitis and atherosclerotic cardiovascular disease. Am J Cardiol. 2009;104(1):59–68.
- Shacter E, Weitzman A. Chronic Inflammation and Cancer. Colorectal Cancer, Oncol Journ. January 31, 2002.
- Rakoff-Nahoum S. Why Cancer and Inflammation? Yale J Biol Med. 2006 Dec; 79(3-4): 123–130.
- Caton J, Ryan ME. Clinical studies on the management of periodontal diseases utilizing subantimicrobial dose doxycycline (SDD). Pharmacol Res. 2011 Feb;63(2):114-20.
- Ashley RA. Clinical trials of a matrix metalloproteinase inhibitor in human periodontal disease. SDD Clinical Research Team. Ann N Y Acad Sci. 1999 Jun 30;878:335-46.
- Preshaw PM. Host response modulation in periodontics. Periodontol 2000. 2008;48:92-110.
- Gu Y, Walker C, Ryan ME, Payne JB, Golub LM. Nonantibacterial tetracycline formulations: clinical applications in dentistry and medicine. J Oral Microbiol. 2012;4: doi: 10.3402/ jom.v4i0.19227.
- Caton JG, Ciancio SG, Blieden TM, et coll. Treatment with subantimicrobial dose doxycycline improves the efficacy of scaling and root planing in patients with adult periodontitis. J Periodontol 2000:71:521-32.
- Lee JY, Lee YM, Shin SY, Seol YJ, Ku Y, Rhyu IC, Chung CP, Han SB. Effect of subantimicrobial dose doxycycline as an effective adjunct to scaling and root planing. J Periodontol. 2004 Nov;75(11):1500-8.
- Preshaw PM, Hefti AF, Bradshaw MH. Adjunctive subantimicrobial dose doxycycline in smokers and nonsmokers with chronic periodontitis. J Clin Periodontol. 2005 Jun;32(6):610-6.
- Novak MJ, Johns LP, Miller RC, et al. Adjunctive benefits of subantimicrobial dose doxycycline in the management of severe, generalized, chronic periodontitis. J Periodontol 2002:72:762-9.
- Mohammad AR, Preshaw PM, Bradshaw MH, Hefti AF, Powala CV, Romanowicz M.Adjunctive subantimicrobial dose doxycycline in the management of institutionalised geriatric patients with chronic periodontitis. Gerontology. 2005 Mar;22(1):37-43.
- Smiley C. J., Tracy S. L. et al. Evidence-based clinical practice guideline on the nonsurgical treatment of chronic periodontitis by means of SRP with or without adjunct, JADA, July 2015, Volume 146, Issue 7, Pages 525–535.
- Novak MJ, Dawson DR 3rd, Magnusson I, Karpinia K, Polson A, Polson A, Ryan ME, Ciancio S, Drisko CH, Kinane D, Powala C, Bradshaw M. Combining host modulation and topical antimicrobial therapy in the management of moderate to severe periodontitis: a randomized multicenter trial. J Periodontol. 2008 Jan;79(1):33-41.
- Preshaw PM, Hefti AF, Novak MJ, Michalowicz BS, Pihlstrom BL, Schoor R, Trummel CL, Dean J, Van Dyke TE, Walker CB, Bradshaw MH. Subantimicrobial dose doxycycline enhances the efficacy of scaling and root planing in chronic periodontitis: a multicenter trial. J Periodontol. 2004 Aug;75(8):1068-76.
- Caton JG, Ciancio SG, Blieden TM, Bradshaw M, Crout RJ, Hefti AF, Massaro JM, Polson AM, Thomas J, Walker C. Subantimicrobial dose doxycycline as an adjunct to scaling and root planing: post-treatment effects. J Clin Periodontol. 2001 Aug;28(8):782-9.
- Golub LM, Lee HM, Stoner JA, et al. Subantimicrobial dose doxycycline modulates gingival crevicular fluid biomarkers of periodontitis in postmenopausal osteopenic women. J Periodontol 2008:79:1409-18.
- Diabetes: Canada at the Tipping Point. Canadian Diabetes Association. http://www.diabetes.ca/CDA/media/documents/publications-and-newsletters/advocacy-reports/canada-at-thetipping-point-english.pdf
- Engebretson SP, Hyman LG, Michalowicz BS, Schoenfeld ER, Gelato MC, Hou W, Seaquist ER, Reddy MS, Lewis CE, Oates TW, Tripathy D, Katancik JA, Orlander PR, Paquette DW, Hanson NQ, Tsai MY. The effect of nonsurgical periodontal therapy on hemoglobin A1c levels in persons with type 2 diabetes and chronic periodontitis: a randomized clinical trial. JAMA. 2013 Dec 18;310(23):2523-32. Engebretson SP, Hey-Hadavi J. Sub-antimicrobial doxycycline for periodontitis reduces hemoglobin A1c in subjects with type 2 diabetes: a pilot study. Pharmacol Res. 2011 Dec;64(6):624-9.
- Ridker PM, Hennekens CH, Buring JE, et coll. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women. N Engl J Med. 2000;342(12):836–843.
- Ridker PM, Rifai N, Rose L, et al. Comparison of C-reactive protein and low-density lipoprotein cholesterol levels in the prediction of first cardiovascular events. N Engl J Med. 2002;347(20):1557–1565.
- Payne JB, Golub LM, Stoner JA, Lee HM, Reinhardt RA, Sorsa T, Slepian MJ. The effect of subantimicrobial-dosedoxycycline periodontal therapy on serum biomarkers of systemic inflammation: a randomized, double-masked, placebo-controlled clinical trial. J Am Dent Assoc. 2011 Mar;142(3):262-73.
- Brown DL, Desai KK, Vakili BA, Nouneh C, Lee HM, Golub LM. Clinical and biochemical results of the metalloproteinase inhibition with subantimicrobial doses of doxycycline to prevent acute coronary syndromes (MIDAS) pilot trial. Arterioscler Thromb Vasc Biol. 2004 Apr;24(4):733-8.
- http://www.osteoporosis.ca/osteoporosis-and-you/osteoporosis-facts-and-statistics/
- Payne JB, Golub LM. Using tetracyclines to treat osteoporotic/ osteopenic bone loss: From the basic science laboratory to the clinic. Pharmacological Res. 63 (2), pp 121-129, 2011.
- Golub L.M., Ramamurthy N.S., Llavaneras A., Ryan M.E., Lee H.M., Liu Y., Bain S. and Sorsa T.: A chemically modified nonantimicrobial tetracycline (CMT-8) inhibits gingival matrix metalloproteinases, periodontal breakdown, and extraoral bone loss in ovariectomized rats. Ann. N.Y. Acad. Sci., 878: 290-310, 1999.
- Golub LM, Lee HM, Stoner JA, Reinhardt RA, Sorsa T, Goren AD, Payne JB. Doxycycline effects on serum bone biomarkers in post-menopausal women. J Dent Res. 2010 Jun;89(6):644-9.
- O’Dell JR, Elliot JR, Mallek JA, Mikuls TR, Weaver CA, Glickstein S, et al. Treatment of early seropositive rheumatoid arthritis: doxycycline plus methotrexate alone. Arthritis Rheum. 2006;54:621-7.
